Život i smrt tradicionalno se smatraju suprotnostima. Ali pojava novih višećelijskih oblika života iz ćelija mrtvog organizma uvodi "treće stanje" koje se nalazi izvan tradicionalnih granica života i smrti.
Obično naučnici smrt smatraju nepovratnim prekidom funkcioniranja organizma kao cjeline. Međutim, prakse poput doniranja organa naglašavaju kako organi, tkiva i stanice mogu nastaviti funkcionirati čak i nakon smrti organizma.
Ova otpornost postavlja pitanje: Koji mehanizmi omogućuju određenim stanicama da nastave funkcionisati nakon što je organizam umro?
Autori ovog teksta su istraživači koji istražuju šta se događa unutar organizama nakon smrti. U svojoj nedavno objavljenoj recenziji opisujuo kako određene stanice – kada im se daju hranjive tvari, kisik, bioelektricitet ili biohemijski znakovi – imaju sposobnost preobražavanja u višestanične organizme s novim funkcijama nakon smrti.
Život, smrt i nastanak nečeg novog
Treće stanje izaziva način na koji naučnici obično razumiju ponašanje ćelija. Dok gusjenice koje se pretvaraju u leptire ili punoglavci koji evoluiraju u žabe mogu biti poznate razvojne transformacije, postoji nekoliko slučajeva u kojima se organizmi mijenjaju na načine koji nisu unaprijed određeni.
Tumori, organoidi i ćelijske linije koje se mogu neograničeno dijeliti u petrijevoj zdjelici, poput HeLa stanica, ne smatraju se dijelom trećeg stanja jer ne razvijaju nove funkcije.
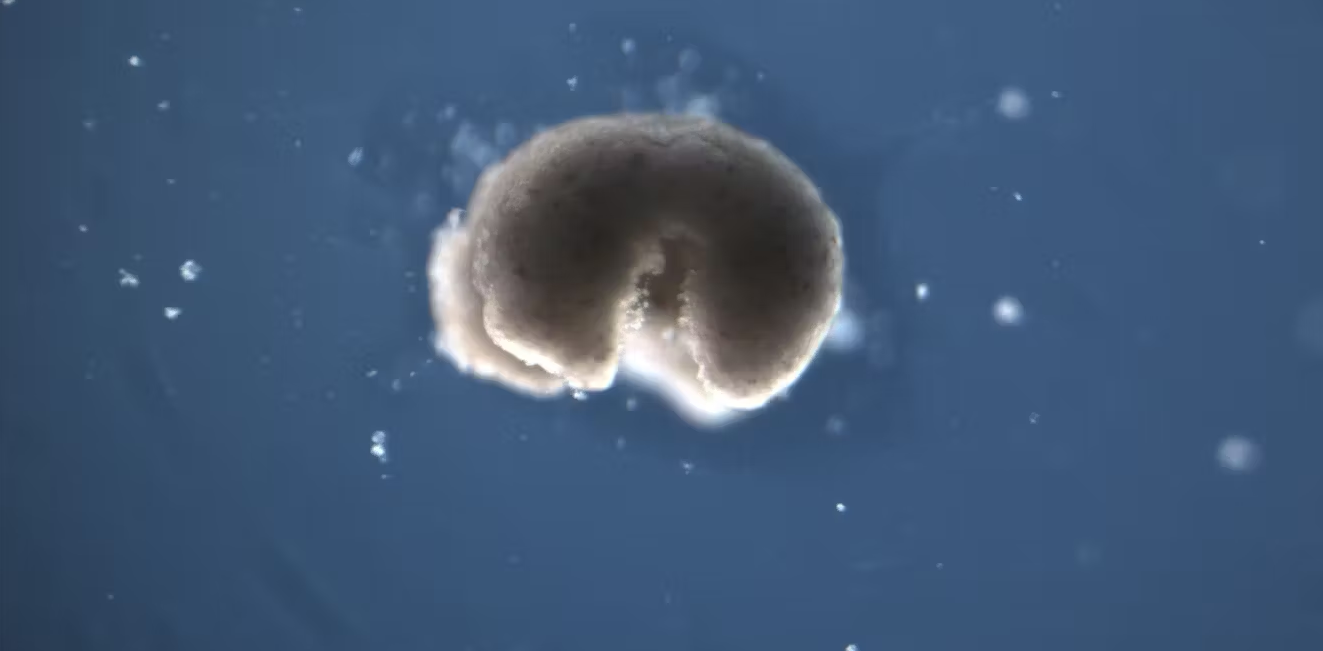
Međutim, istraživači su otkrili da su se stanice kože izvađene iz preminulih embrija žaba mogle prilagoditi novim uvjetima petrijeve zdjelice u laboratoriju, spontano se reorganizirajući u višestanične organizme zvane ksenoboti.
Ti su organizmi pokazali ponašanje koje se proteže daleko izvan njihovih izvornih bioloških uloga. Tačnije, ovi ksenoboti koriste svoje cilije – male strukture nalik dlakama – za navigaciju i kretanje kroz okolinu, dok se u živom žabljem embriju cilije obično koriste za pomicanje sluzi.
Ksenoboti također mogu izvršiti kinematičku samoreplikaciju, što znači da mogu fizički replicirati svoju strukturu i funkciju bez rasta. Ovo se razlikuje od uobičajenih procesa replikacije koji uključuju rast unutar ili na tijelu organizma.
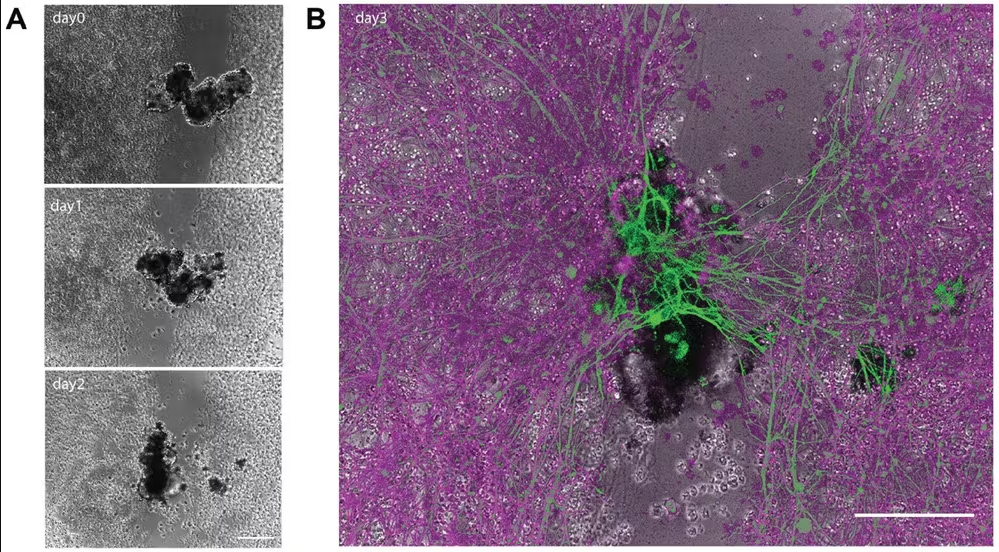
Istraživači su također otkrili da se usamljene stanice ljudskih pluća mogu same sastaviti u minijaturne višestanične organizme koji se mogu kretati. Ovi antroboti se ponašaju i strukturirani su na nove načine. Oni ne samo da se mogu snalaziti u svojoj okolini, već također popravljaju i sebe i povrijeđene neuronske stanice smještene u blizini.
Uzeti zajedno, ovi nalazi pokazuju inherentnu plastičnost staničnih sistema i dovode u pitanje ideju da se stanice i organizmi mogu razvijati samo na unaprijed određene načine. Treće stanje sugerira da smrt organizma može igrati značajnu ulogu u tome kako se život mijenja tokom vremena.
Posmrtni uvjeti
Nekoliko faktora utječe na to hoće li određene stanice i tkiva moći preživjeti i funkcionirati nakon što organizam umre. To uključuje uvjete okoliša, metaboličku aktivnost i tehnike očuvanja.
Različite vrste stanica imaju različita vremena preživljavanja. Na primjer, kod ljudi, bijele krvne stanice umiru između 60 i 86 sati nakon smrti organizma. Kod miševa, stanice skeletnih mišića mogu ponovno izrasti nakon 14 dana postmortem, dok se stanice fibroblasta iz ovaca i koza mogu uzgajati do mjesec dana ili dva postmortem.
Metabolička aktivnost igra važnu ulogu u tome mogu li stanice nastaviti preživjeti i funkcionirati. Aktivne stanice koje zahtijevaju kontinuiranu i znatnu opskrbu energijom za održavanje svoje funkcije teže je uzgajati nego stanice s nižim energetskim potrebama.
Tehnike očuvanja kao što je krioprezervacija mogu omogućiti uzorcima tkiva kao što je koštana srž da funkcioniraju slično kao izvori živih darivatelja.
Inherentni mehanizmi preživljavanja također igraju ključnu ulogu u tome hoće li stanice i tkiva nastaviti živjeti. Na primjer, istraživači su uočili značajno povećanje aktivnosti gena povezanih sa stresom i gena povezanih s imunološkim sistemom nakon smrti organizma, što će vjerovatno nadoknaditi gubitak homeostaze.
Štaviše, faktori kao što su trauma, infekcija i vrijeme proteklo od smrti značajno utječu na vitalnost tkiva i stanica.
Faktori kao što su dob, zdravlje, spol i vrsta vrste dalje oblikuju postmortem krajolik. To se vidi u izazovu uzgoja i presađivanja metabolički aktivnih stanica otočića, koje proizvode inzulin u gušterači, od donora do primatelja.
Istraživači vjeruju da bi autoimuni procesi, visoki troškovi energije i degradacija zaštitnih mehanizama mogli biti razlozi mnogih neuspjelih transplantacija otočića.
Ostaje nejasno kako međudjelovanje ovih varijabli omogućuje određenim stanicama da nastave funkcionirati nakon što organizam umre. Jedna je hipoteza da specijalizirani kanali i pumpe ugrađeni u vanjske membrane stanica služe kao zamršeni električni krugovi.
Ovi kanali i pumpe generiraju električne signale koji omogućuju stanicama da međusobno komuniciraju i izvršavaju specifične funkcije kao što su rast i kretanje, oblikujući strukturu organizma koju čine.
Također je neizvjesno u kojoj se mjeri različite vrste stanica mogu podvrgnuti transformaciji nakon smrti. Prethodno je istraživanje otkrilo da se specifični geni uključeni u stres, imunitet i epigenetičku regulaciju aktiviraju nakon smrti kod miševa, zebrica i ljudi, što ukazuje na široki potencijal za transformaciju među različitim tipovima stanica.
Implikacije za biologiju i medicinu
Treće stanje ne samo da nudi nove uvide u prilagodljivost stanica. Također nudi izglede za nove tretmane.
Na primjer, antroboti bi mogli biti dobiveni iz živog tkiva pojedinca za isporuku lijekova bez pokretanja neželjenog imunološkog odgovora. Konstruirani antroboti ubrizgani u tijelo potencijalno bi mogli otopiti arterijski plak kod pacijenata s aterosklerozom i ukloniti višak sluzi kod pacijenata s cističnom fibrozom.
Važno je da ti višestanični organizmi imaju ograničen životni vijek, prirodno se razgrađuju nakon četiri do šest sedmica. Ovaj "kill switch" sprečava rast potencijalno invazivnih stanica.
Bolje razumijevanje načina na koji neke stanice nastavljaju funkcionirati i metamorfozirati u višestanične entitete neko vrijeme nakon smrti organizma obećava napredak personalizirane i preventivne medicine.
Autori teksta objavljenog na Science Alertu su Peter A Noble, pridruženi profesor mikrobiologije, Univerzietat Washington i Alex Pozhitkov, viši tehnički voditelj bioinformatike, Irell & Manella Graduate School of Biological Sciences na City of Hope